胰腺导管腺癌(PDAC)是一种极具侵袭性的恶性肿瘤,2023年已成为癌症相关死亡的第三大原因,预计到2040年将升至第二位。其快速进展的关键因素之一是高发的周围神经浸润,这与严重的神经病理性疼痛和不良预后密切相关。研究表明,PDAC 细胞通过自分泌和旁分泌信号促进神经重塑,而重塑的神经又反过来推动肿瘤生长,因此靶向 PDAC 神经支配成为极具潜力的治疗策略。
利多卡因是临床常用的酰胺类局部麻醉药,可通过阻断电压门控钠离子通道减少疼痛刺激的神经传导,且在部分肿瘤中显示出抗肿瘤特性,如作为苦味受体13(T2R13)激动剂引发肿瘤细胞线粒体钙超载、抑制蛋白酶体活性,进而诱导凋亡。然而,利多卡因在PDAC临床应用中存在瓶颈:常规剂量下肿瘤内药物蓄积不足,难以发挥疗效;高剂量使用则会引发严重的中枢神经系统毒性和心脏毒性。此外,PDAC的另一关键特征为显著的间质增生,表现为胶原蛋白等细胞外基质成分的过度分泌,这一过程不仅促进PDAC的进展与治疗抵抗,同时也构成了药物递送的重要障碍。然而,这种异常积累的细胞外基质也为药物靶向递送策略的设计提供了潜在机遇。
针对上述问题,yL23411永利官网登录魏景艳教授、国家纳米科学中心聂广军研究员/李一叶研究员团队联合设计了一种胶原靶向、肿瘤微环境(TME)响应的脂质体(C-DCL@L)递送利多卡因,通过调控 PDAC 神经支配抑制肿瘤进展(图1)。
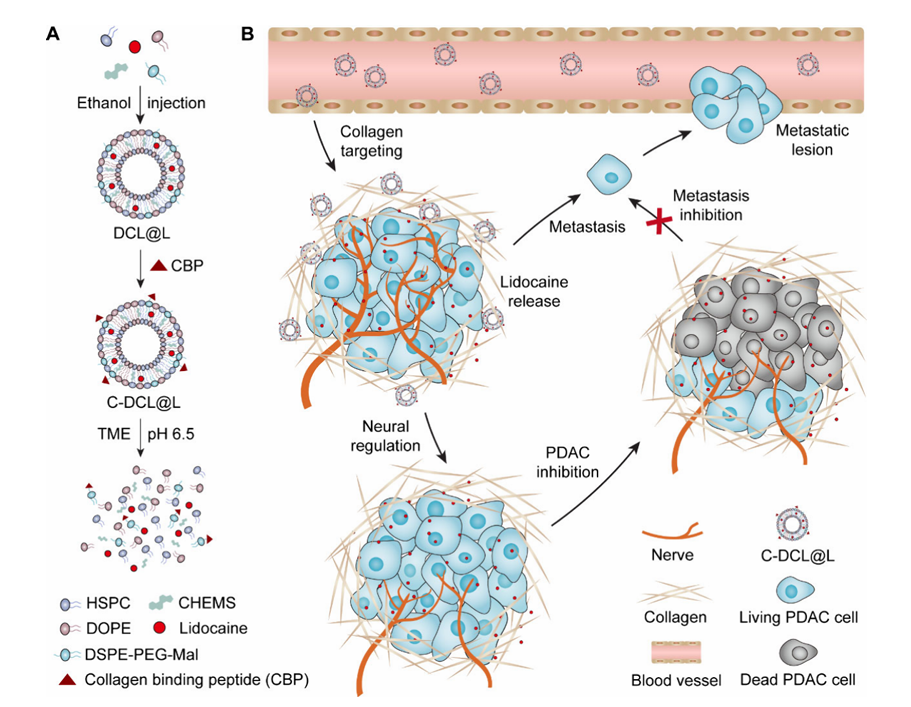
图1 C-DCL@L 合成与抗肿瘤机制示意图
C-DCL@L构建和表征:
1.核心载体设计:以1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)和胆固醇半琥珀酸酯(CHEMS)为pH响应组分,构建pH敏感脂质体(DCL)。在中性环境中,DOPE维持脂质体双分子层结构;进入酸性TME(pH6.5)后,DOPE和CHEMS质子化破坏双分子层稳定性,实现药物快速释放。
2.药物负载与靶向修饰:将利多卡因嵌入 DCL 疏水层形成载药脂质体(DCL@L),通过迈克尔加成反应将胶原结合肽(CBP)与 DCL@L 表面的马来酰亚胺基团偶联,得到靶向纳米药物C-DCL@L。
3.性能优化:通过调整DCL与利多卡因质量比至20:1,实现74.96±2.15%的高包封率;CBP修饰后,脂质体粒径从约84.46nm增至88.71nm,zeta电位从-32.27mV升至-27.90mV,且在生理pH 7.4条件下96小时内形态、粒径稳定,在pH 6.5时响应酸性微环境,96小时内利多卡因累积释放率达70.71±2.43%(图 2)。
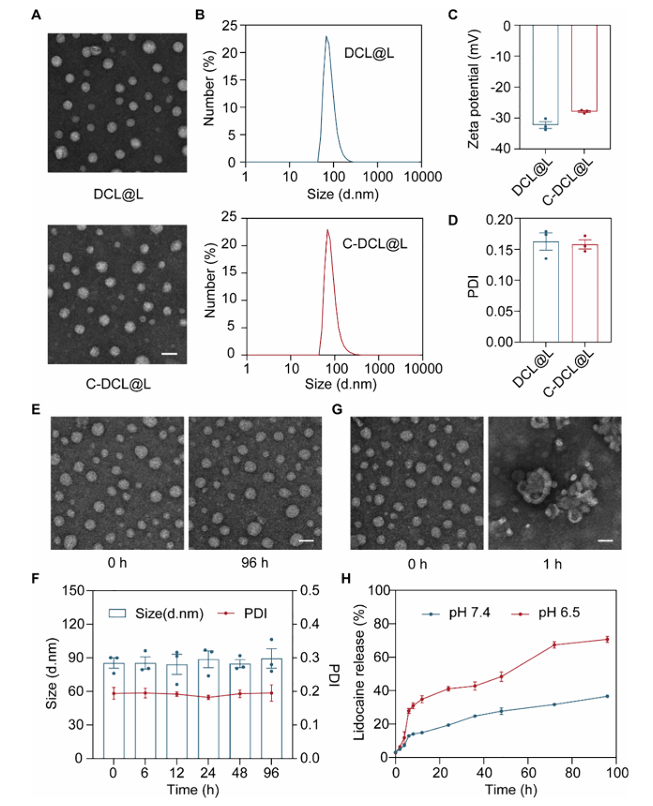
图2 C-DCL@L 理化性质表征图
体外实验验证了C-DCL@L的神经调控与间接抗肿瘤效果:
1.神经选择性抑制:神经元对利多卡因的敏感性远高于 PDAC 细胞,0.5 mM 利多卡因可使背根神经节(DRG)神经元轴突长度减少 35%(KPC 细胞 IC50为 2.46 mM);C-DCL@L处理后,神经元突起长度减少 81.5%,且不影响神经元与 KPC 细胞活性(图 3)。
2.阻断神经-肿瘤交互作用:收集经不同制剂处理的 DRG 细胞条件培养基(CM)培养 KPC 细胞,结果显示,神经元 CM 可促进 KPC 细胞活力与迁移,而 C-DCL@L 处理的神经元 CM 能显著抑制这一效应,证明其通过抑制神经间接抑制肿瘤细胞增殖与迁移(图 3)。
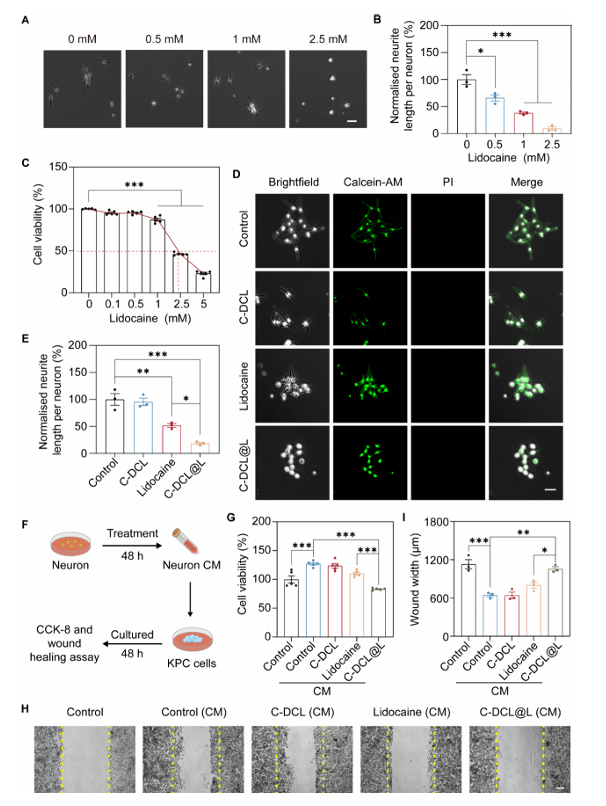
图3 体外神经调控与肿瘤细胞影响实验图
体内药代动力学与 biodistribution 实验表明:
1.C-DCL@L 可将荧光染料 Did 的半衰期从 3.73 小时延长至 6.42 小时,延长药物体内循环时间;
2.在 PDAC 致密微环境中,C-DCL@L 的胶原结合能力使肿瘤内药物累积量显著提升,是游离药物组的5.7倍、非靶向脂质体(S-DCL@L)组的1.8倍,且在给药48小时后仍能检测到肿瘤内药物信号(图 4)。
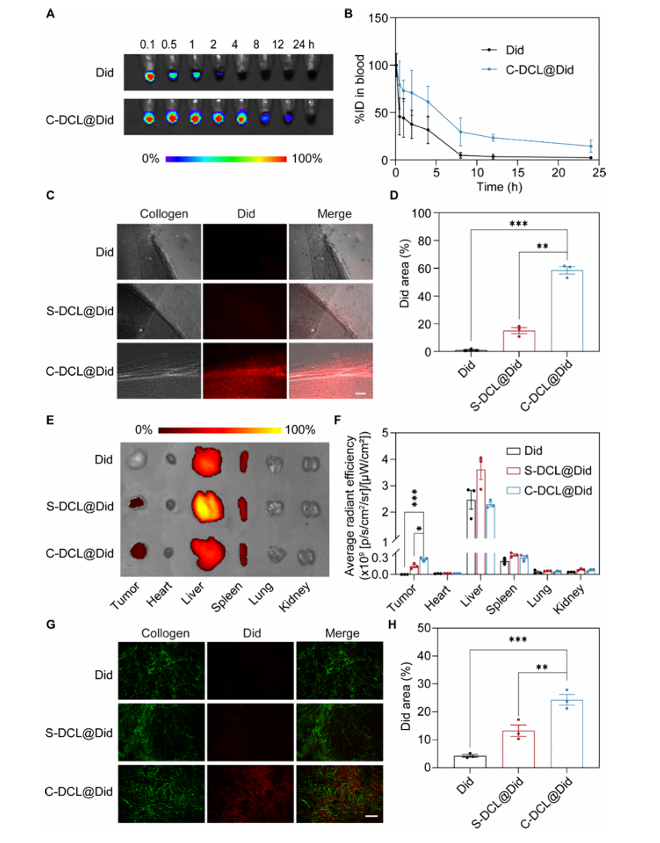
图4 体内药代动力学与 biodistribution 图
在PDAC原位小鼠模型中,C-DCL@L展现出优异的抗肿瘤与抗转移效果:
1.与对照组相比,C-DCL@L处理肿瘤生长抑制率达84.06%,显著高于游离利多卡因组(41.96%)与 S-DCL@L 组(52.30%);
2.肿瘤内神经标志物PGP9.5表达量降至1.89%,Ki67阳性细胞比例从18.81% 降至 8.65%,证明神经抑制有效减少肿瘤增殖;
3.肠系膜转移灶数量显著减少,且治疗期间小鼠体重、肝肾功能、血糖水平均无异常,主要器官无组织学损伤,体现良好生物安全性(图 5)。
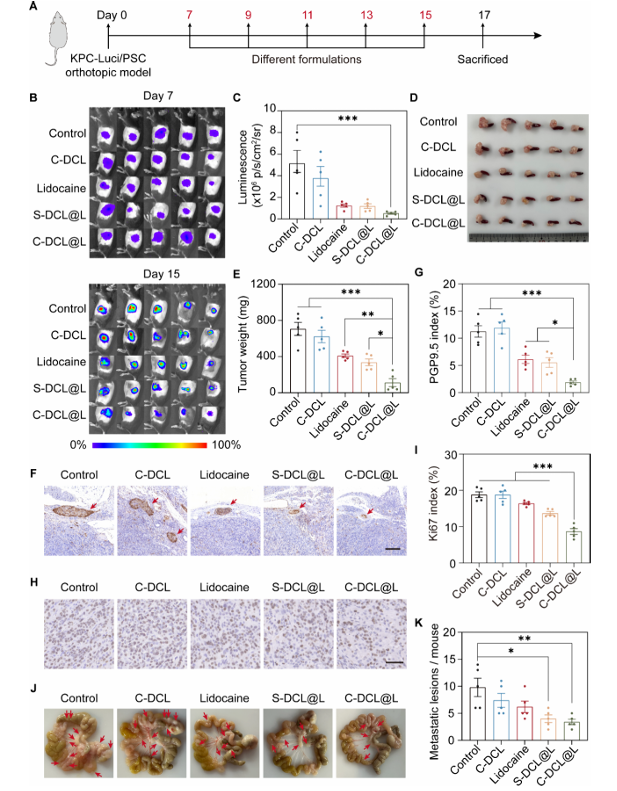
图5 体内抗肿瘤与抗转移效果验证图
该研究开发的 C-DCL@L 纳米药物,通过胶原靶向与 TME 响应实现利多卡因的精准递送,以“神经抑制”为核心机制阻断PDAC神经-肿瘤交互作用,为PDAC治疗提供了新型纳米调控策略。同时,研究也指出小鼠与人类PDAC神经解剖存在差异,未来需利用基因工程小鼠模型进一步验证该策略的临床转化潜力。
论文链接:https://doi.org/10.1021/acs.nanolett.4c05617